Új rákellenes hatóanyagot fejlesztettek ki az ELTE kutatói
Kimagasló aktivitású, kis dózisban alkalmazható új magyar rákellenes gyógyszermolekula-jelöltet fejlesztettek ki az ELTE kutatói a Szint-Plusz Tématerületi Kiválósági Program keretében.
Az ELTE Szerves Kémiai Tanszék munkatársai TBP–333 kódnéven, két fluor- és egy klóratommal speciális módon helyettesített származékot fejlesztettek ki mint minden eddiginél hatékonyabb rákellenes hatóanyagjelöltet.
A tumoros megbetegedések világszerte a vezető halálozási okok között szerepelnek. Az 1990-es évektől kezdve ugrásszerűen megemelkedett a rákbetegek aránya, 2022-ben a rákos megbetegedések miatt bekövetkező halálesetek összesített száma az EU tagállamaiban és az Egyesült Királyságban megközelítette a másfél milliót.
A rákos elváltozások kezelése komoly kihívást jelent. A hagyományos kemoterápiás kezelések során gyógyszerként olyan hatóanyagokat alkalmaznak, amelyek elpusztítják ugyan a tumoros sejtek többségét, de az egészséges sejteket is jelentős mértékben károsítják, miközben számos mellékhatást okoznak. További súlyos probléma az áttétek megjelenésével járó daganatok újbóli kifejlődése és a kemoterápiás szerekkel szemben gyakran kialakuló rezisztencia is.
Ezért az utóbbi években kiemelkedő szerep jutott az úgynevezett célzott onkológiai terápiás eljárásoknak, amelyek során a felhasznált szer a sejtciklus szabályozásában hibásan működő rákos sejtek kontrollálatlan osztódását molekuláris szinten gátolva leállítja a daganatsejt növekedését. Ezek a kezelések meghatározott sejten belüli molekuláris célpontokra, például fehérjékre irányulnak. Az elmúlt években törzskönyvezett ilyen hatású gyógyszermolekulák közé tartoznak a ClpP fehérjét célba vevő, az Egyesült Államokban kifejlesztett kismolekulás potenciális rákellenes imipridononok, amelyek legismertebb képviselői az ONC–201 és ONC–212.
Az ELTE Természettudományi Karán is folynak rákellenes hatóanyagok kifejlesztésére irányuló kutatások a Szint-Plusz Tématerületi Kiválósági Program támogatásával. A Szerves Kémiai Tanszék munkatársai eddig több mint 140 új vegyületet állítottak elő, amelyek közül a TBP–333 kódnévvel ellátott, két fluor- és egy klóratommal speciális módon helyettesített származék minden eddiginél hatékonyabb potenciális rákellenes hatóanyagjelöltnek bizonyul.
Az új magyar szer hatása az összehasonlító tesztek szerint jelentős mértékben meghaladja az amerikai fejlesztők (hasnyálmirigy karcinómában és leukémiában szenvedő betegek bevonásával hamarosan humán klinikai tesztekre kerülő) legígéretesebb hatóanyagjelöltjeként tekintett ONC–212-ét.
A kemoterápiás kezelésekkel szemben nagymértékű rezisztenciát mutató PANC–1 hasnyálmirigy karcinóma sejtekkel szemben a TBP–333 vegyület a szervezetet toxicitás szempontjából jóval kevésbé megterhelő módon, így a káros mellékhatások várható háttérbe szorítása mellett már több nagyságrenddel kisebb dózisban is fejt ki tumorellenes hatást, mint az ONC–212, lévén annál mintegy 4000-szer hatékonyabb.
Ez a mérési adatok szerint azt jelenti, hogy a TBP–333 vegyület a PANC–1 hasnyálmirigy karcinóma sejtek 50 százalékát mintegy 4000-szer alacsonyabb dózisban képes elpusztítani, mint az ONC–212. A hatóanyagjelölt rendkívüli hatását számos más, humán rákos sejtvonalon végzett vizsgálat is megerősítette, és már hormonfüggetlen agresszív emlőrákmodelleken kivitelezett állatkísérletek is egyértelműen bizonyítják.
Az ELTE-s kutatócsoportot Csámpai Antal vezeti, az általuk felismert szerkezet-hatás összefüggés képezi szabadalmi beadványuk alapját.
A TBP–333 vegyület nemzetközi szinten is bizonyított, a magyar kutatókkal együttműködő torontói kutatócsoport vizsgálta és igazolta hatékonyságát. A beszámoló szerint ahhoz, hogy a hatóanyagjelölt klinikai alkalmazása is lehetővé váljon, egyebek mellett kiterjedt biológiai kutatásokra van szükség.
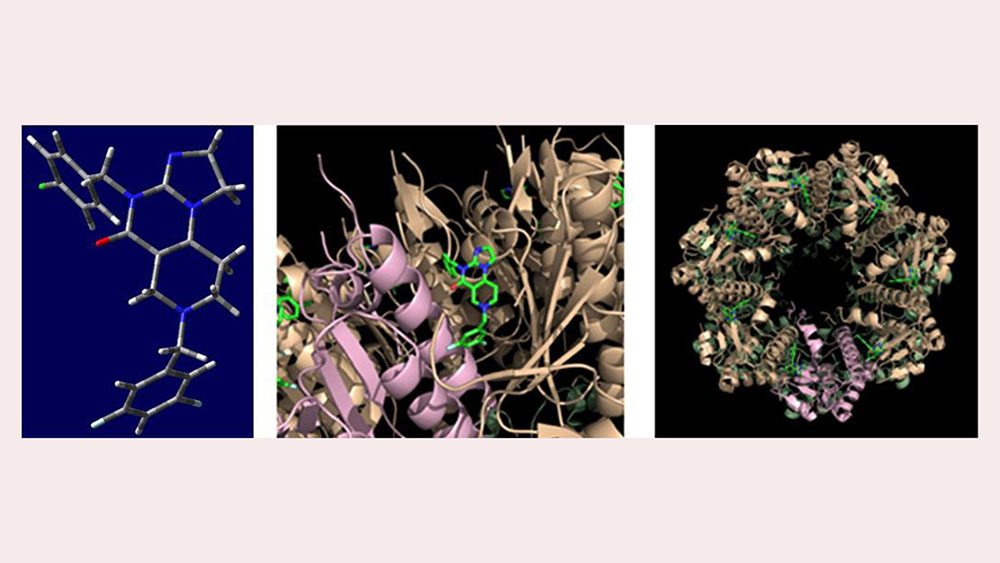
A képen bal oldalon a TBP–333 molekulának a ClpP célfehérjéhez való kötődésre alkalmas térszerkezeti modellje; középen a TBP–333 molekuláknak ClpP-vel alkotott komplexének egy kinagyított részlete; jobb oldalon a heptamerré szerveződő ClpP egység a hét darab kötött TBP–333 molekulával. Forrás: ELTE